Etat de la recherche clinique en France dans le DM : le baromètre de l’AFCROs
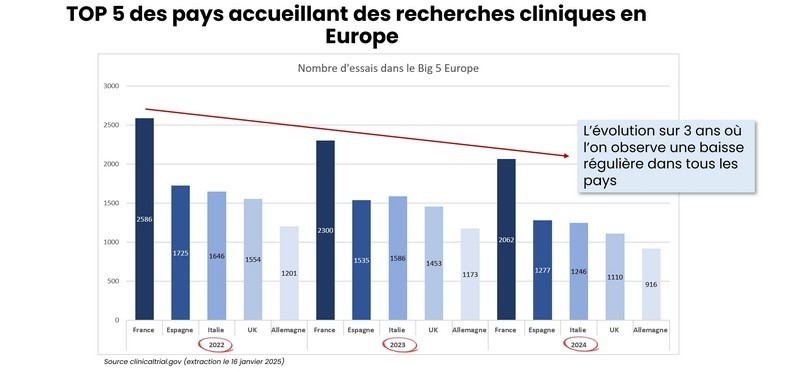
Même si la France conserve encore en 2024 la pole position en Europe en nombre total d'essais cliniques réalisés, ce secteur d'activité est en nette perte de vitesse (2062 contre 2586 en 2022). L'AFCROs en analyse les causes dans son baromètre annuel dont l'édition 2025 vient d'être officialisée.
Par Baptiste Menguy du groupe AFCROs-DM
Le baromètre de l'AFCROs 2025, qui a été présenté le 11 mars dernier lors de la Journée de la Recherche Clinique (JRC 2025) organisée par l'association, est destiné à analyser toutes les catégories d'études cliniques portant sur le médicament ou sur le dispositif médical, qu'elles soient interventionnelles ou observationnelles, à promotion industrielle ou académique. Ce baromètre s'appuie sur des données extraites de clinicaltrial.gov, avec un redressement des résultats pour 2024 afin de corriger l'effet des déclarations tardives.
Une nette diminution du nombre d'études cliniques sur DM en 2 ans
Le baromètre s'inscrit dans un contexte de baisse constante du nombre d'études cliniques sur le territoire européen depuis la fin de la pandémie de COVID-19, une tendance qui affecte tous les pays européens, avec des variations selon les pays.
La France subit pour sa part une diminution continue du nombre d'études cliniques menées sur son territoire, notamment dans le domaine du dispositif médical. En ce qui concerne spécifiquement ce secteur, la baisse qu'elle a enregistrée en 2024 est comparable à celle observée sur les études relatives aux médicaments, ce qui n'était pas le cas en 2023.
Ce recul s'articule de la manière suivante :
- 2022 : 259 études (54 % à promotion industrielle, 46 % à promotion académique) ;
- 2023 : 253 études (59 % à promotion industrielle, 41 % à promotion académique) ;
- 2024 : 219 études (27 % à promotion industrielle, 63 % à promotion académique).
Cette baisse de 13,4% entre 2023 et 2024 est significative et suit la tendance générale de diminution des études cliniques en France.
Types d'études les plus impactés
Pour les dispositifs médicaux, la baisse observée en 2024 touche essentiellement les études observationnelles. Cette diminution pourrait être liée aux nouvelles exigences des règlements européens sur les DM (MDR) et sur les DMDIV (Dispositifs Médicaux de Diagnostic In Vitro) (IVDR). Les études observationnelles ont en effet moins leur place dans le cadre de ces nouvelles exigences réglementaires, qui privilégient davantage les études interventionnelles pour évaluer la performance et la sécurité des dispositifs.
Répartition entre promoteurs industriels et académiques
L'analyse des données montre une évolution contrastée entre les études à promotion industrielle et académique pour les dispositifs médicaux :
- Études à promotion industrielle : une baisse continue (120 en 2022, 103 en 2023, 81 en 2024), soit une diminution de 32,5 % sur deux ans,
- Études à promotion académique : une légère baisse en 2024 (138) après une hausse en 2023 (150), par rapport à 2022 (139).
Cette tendance reflète une difficulté croissante pour les industriels à mener des études cliniques sur les dispositifs médicaux en France, tandis que la recherche académique résiste mieux à cette baisse.
Deux raisons essentielles à la baisse observée
Le baromètre distingue essentiellement deux facteurs qui expliquent cette évolution : l'impact des évolutions règlementaires et la concurrence internationale.
- Impact réglementaire :
L'entrée en application du MDR et de l'IVDR a eu un impact significatif sur la conduite des études cliniques. Ce nouveau cadre réglementaire, plus exigeant que le précédent, nécessite un temps d'adaptation plus important que prévu pour les promoteurs d'études cliniques.
Le MDR impose des exigences renforcées en matière d'investigations cliniques, notamment des données cliniques plus robustes pour démontrer la sécurité et les performances des dispositifs et un renforcement des obligations en matière de suivi clinique après commercialisation.
Ces nouvelles exigences expliquent en partie la baisse des études observationnelles au profit d'études interventionnelles plus ciblées et plus conformes aux nouvelles attentes réglementaires.
- Positionnement international :
La baisse des études sur les dispositifs médicaux en France s'inscrit dans un contexte de concurrence internationale accrue. D'autres régions du monde, notamment l'Asie-Pacifique et les États-Unis offrent des conditions plus favorables pour la conduite d'études cliniques sur les dispositifs médicaux. C'est également le cas pour des pays situés au sein-même de l'Europe. Ils offrent notamment comme avantages :
- des délais d'autorisation plus courts,
- des procédures administratives simplifiées,
- des coûts de mise en œuvre potentiellement moins élevés et la prise en charge d'une partie des coûts de l'investigation.
Une évolution récente au sein de l'Europe
Bien que le baromètre ne détaille pas spécifiquement le classement européen pour les études sur les dispositifs médicaux, il note un déplacement des démarrages d'essais cliniques, toutes catégories confondues, de l'Europe du Nord et de l'Ouest vers l'Europe du Sud, notamment l'Espagne, le Portugal et la Grèce.
Pour les études à promotion industrielle en général, l'Espagne conserve la première place européenne, un modèle dont la France pourrait s'inspirer pour les dispositifs médicaux. Le baromètre souligne que l'Espagne a su apporter des garanties sur la mise en place rapide des essais sur son territoire, notamment en termes de délais d'autorisations, d'ouverture des sites et de délai d'inclusion des patients.
Perspectives et recommandations
Pour renforcer l'attractivité de la France dans le domaine des études cliniques sur les dispositifs médicaux, plusieurs pistes peuvent être envisagées, en particulier :
- S'adapter au nouveau cadre règlementaire :
Les acteurs français de la recherche clinique sur les dispositifs médicaux doivent poursuivre leur adaptation aux exigences des règlements MDR et IVDR. Cela implique :
(1) une meilleure anticipation des besoins en données cliniques,
(2) une optimisation des protocoles d'études pour répondre aux exigences réglementaires,
(3) un renforcement des compétences en matière de conduite d'investigations cliniques conformes aux nouvelles normes.
- Améliorer les délais et les procédures :
À l'instar de l'Espagne, la France pourrait travailler à l'amélioration des délais et des procédures administratives pour les études sur les dispositifs médicaux : réduction des délais d'autorisation des études, simplification des procédures d'ouverture des sites investigateurs, optimisation des processus de recrutement des patients.
- Soutenir l'innovation :
L’AFCROs a porté auprès des autorités une série de mesures pour renforcer la position de la France au sein de l'Europe en matière de recherche clinique (cf communiqué du 19 juin 2024 : L'appel des entreprises de la recherche clinique : « sauvons l’excellence française ! » à retrouver sur le site de l'AFCROs).
Le maintien d'un écosystème favorable à l'innovation est essentiel pour préserver l'attractivité de la France, à savoir : un renforcement des partenariats entre acteurs académiques et industriels ; l'apport d'un soutien financier aux PME innovantes ; et la valorisation de l'expertise française en matière de recherche clinique.
En résumé...
Le baromètre AFCROs 2025 met en lumière une situation préoccupante pour la recherche clinique sur les dispositifs médicaux en France, avec une baisse continue du nombre d'études depuis 2022. Cette tendance s'explique notamment par l'impact du nouveau cadre réglementaire européen et une concurrence internationale accrue y compris au sein des pays européens.
Malgré ces difficultés, la recherche académique française y compris dans le domaine des dispositifs médicaux résiste mieux que la recherche industrielle, ce qui constitue un atout sur lequel le pays peut capitaliser. Pour inverser la tendance et renforcer sa position européenne, la France doit s'inspirer des bonnes pratiques des pays du sud de l'Europe, notamment l'Espagne, en matière de délais d'autorisation et de mise en œuvre des études cliniques.
L'adaptation au nouveau cadre réglementaire, l'amélioration des procédures administratives et le soutien à l'innovation sont les principales pistes à explorer pour préserver et renforcer l'attractivité de la France dans le domaine des études cliniques sur les dispositifs médicaux.







 X (ex Twitter)
X (ex Twitter) LinkedIn
LinkedIn






















