Les modalités pratiques de l’Ingénierie d’Aptitude à l’Utilisation dans le DM
Concevoir, fabriquer et utiliser les DM de façon à minimiser les risques utilisateur et patient, est un objectif bien connu des industriels. L’Aptitude à l’Utilisation ou Human Factor Engineering en anglais est un outil de choix pour un développement maîtrisé et répondant aux attentes des autorités.
Par Aline Abravanel, Chef de projet international, membre du groupe AFCROs-DM
Bien qu’exigée par la FDA et obligatoire en Europe depuis 2010 (Directive 2007/47/EC sur les dispositifs médicaux), l’approche HFE (Human Factor Engineering) est encore mal connue en France. Elle permet pourtant de répondre à l'exigence essentielle d’ergonomie pour les DM en permettant "d’intégrer l’utilisateur [...] et de prendre en compte la dimension interdisciplinaire de l’interaction humain-machine". Elle constitue donc une étape critique du développement des technologies de santé et des DM.
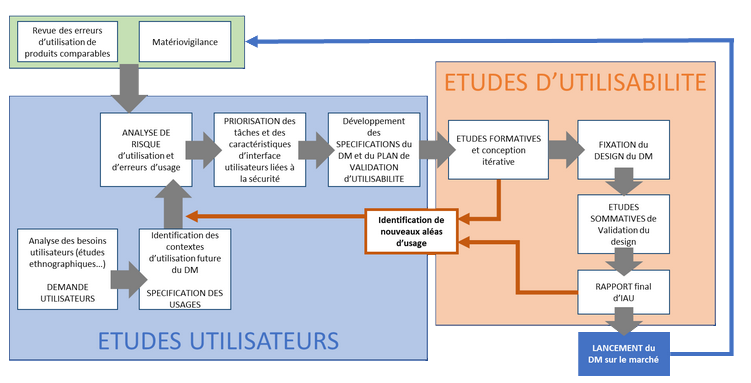
Les normes harmonisées (voir encadré plus bas) imposent plusieurs étapes clés du HFE pouvant être regroupées en deux types : les études d’utilisateurs (Users studies) et les études d’utilisabilité (Usability studies).
Etudes utilisateurs : connaissance du marché et analyse de risques
Les études utilisateurs visent à s’assurer que les principales caractéristiques du DM sont définies en fonction de critères précis d’utilisation par l’utilisateur final. Elles impliquent un large panel de fonctions (R&D, Réglementaire, Médical, Qualité, Marketing et Ventes …) et définissent les spécifications du dispositif. Elles débouchent sur un Plan de Validation d’Utilisabilité (PVU) qui décrit les méthodes, critères de succès et niveau d’implication des utilisateurs prévus dans des scénarios-types et des « scénarios du pire ». Les principaux objectifs des études utilisateurs sont :
- la connaissance des erreurs d’utilisation actuelles (tests comparatifs, screening des retours marché et autres suivis de matériovigilance) ;
- l'analyse des besoins des utilisateurs finaux par le biais d’observations de pratiques actuelles (études ethnographiques) ou d’entretiens individuels ou collectifs (études déclaratives) ;
- la prise en compte de l’utilisation future, sur la base prévue de l’indication médicale, de la population de patients, de la partie du corps ou du type de tissu avec lequel le DM devra interagir, du ou des profil(s) d’utilisateur(s) (patient, aidant ou professionnel de santé), des conditions d’utilisation et des modes opératoires. Ces éléments, critiques, déterminent les bases des spécifications d’utilisabilité et des études complémentaires nécessaires ;
- l'identification des risques liés à l’utilisabilité dans le cadre d’une analyse de risques menée selon la norme ISO 14791, qui inclut l’identification de caractéristiques liées à la sécurité, d’aléas connus ou prévisibles et de situations risquées ;
- l'identification des fonctions nécessitant une interaction entre l’utilisateur et le DM et de celles utilisées le plus fréquemment, permettant de déterminer les fonctions opérationnelles principales.
Etudes d’utilisabilité : une approche rigoureuse de l’évaluation
Sur la base du PVU, le DM entre alors dans une phase itérative dite d’Utilisabilité Formative. Cette étape permet de vérifier que le DM est en ligne avec les spécifications définies en procédant à des tests au plus proche des conditions réelles et couvrant l’ensemble des sous-groupes d’utilisateurs potentiels. Ces essais nécessitent le design et l’implémentation de l’interface utilisateur (les éléments du DM qui sont visibles de l’utilisateur) dans un design approchant de la version finale.
Il y a 3 normes harmonisées auxquelles se référer pour l'approche HFE :
- la norme EN 62366 Medical devices – Application of usability engineering to medical devices ;
- la norme EN ISO 14971 Medical devices – Application of risk management to medical devices;
- la norme EN 60601-1-6 Medical electrical equipment – Part 1-6: General requirements for basis safety and essential performance – Collateral standard: Usability.
Une fois le design final du DM figé vient la phase d’Evaluation Sommative. Etape cruciale de la Validation de l’Aptitude à l’Utilisation (VAU), elle nécessite des compétences pluridisciplinaires et un équipement ou une installation permettant de réaliser les tests « en conditions réelles ». Ici encore, les tests d’utilisabilité se basent sur des simulations de scénarios-types et de scénarios du pire, et doivent être réalisés avec une base suffisante de participants par sous-groupe. A titre d’exemple, un DM utilisé à la fois par des professionnels de santé, des aidants, des patients valides et des patients souffrant de problèmes locomoteurs, devra être testé auprès de ces 4 populations distinctement. Les études de VAU représentent ainsi un investissement significatif dans le développement produit.
Quel accompagnement pour les industriels ?
Si les études utilisateurs ne sont pas stricto sensu des études de marché, elles présentent beaucoup de similitudes avec les études qualitatives (compréhension des besoins et attentes, possibilité d’observer des utilisations simulées, observation ethnographique in situ…). S’y ajoute la dimension d’observation scientifique cadrée et de reporting des succès et échecs d’utilisation dans le cadre de scénarios définis, qui est une compétence évidente des CROs, étant donné la proximité méthodologique avec une collecte de données cliniques servant à établir des preuves scientifiques.
Néanmoins, les études d’utilisabilité et les études cliniques sont deux activités fondamentalement différentes qui ne doivent pas être confondues, bien que la distinction ne soit pas précisée dans les standards et les directives du DM.
Il n’existe pas à proprement parler de filière organisée en Europe pour le soutien aux études utilisateurs et d’utilisabilité. Aussi, en l’absence d’un réseau d’experts européens certifiés, il semble judicieux de se tourner vers des structures disposant d’un historique solide de réalisations passées en matière de HFE.






 X (ex Twitter)
X (ex Twitter) LinkedIn
LinkedIn
























