Choisir une méthodologie statistique pour l’évaluation clinique d’un DM
La méthodologie statistique la mieux adaptée pour confirmer l'intérêt d'un dispositif médical auprès des autorités de santé dépend d'une multitude de facteurs. Elle doit être clairement définie dans le protocole d'investigation clinique. L'AFCROs nous guide ici dans cette démarche délicate.

Céline Fabre s'est appuyée dans cet article sur le guide méthodologique de la HAS "Méthodologie pour le développement clinique des dispositifs médicaux". (source AFCROs)
Par Céline Fabre, membre du groupe AFCROs-DM
La diversité des dispositifs médicaux (invasifs, non invasifs, diagnostiques, thérapeutiques, de surveillance), leur développement croissant ainsi que l’évolution de la réglementation associée à ces DM (Règlement 2017/745) nécessitent de fournir des preuves cliniques suffisantes aux autorités compétentes. Les fabricants doivent présenter des investigations cliniques basées sur une méthodologie robuste et adaptée au contexte scientifique et médical. Cette dernière doit également prendre en compte le développement et l’utilisation en vie réelle du produit afin de permettre son évaluation par les autorités en termes de bénéfices et de risques. C'est pourquoi il est essentiel, pour confirmer l'intérêt d'un DM, de recourir à une méthodologie statistique adaptée.
Protocole d’investigation clinique et méthodologie
Le développement d’un DM se décline en trois étapes : la phase pré-clinique, la phase de faisabilité et la phase d’évaluation clinique. Avant de procéder à l’évaluation clinique du DM, l’étude de faisabilité est déterminante pour définir au mieux la population cible, l’efficacité, les potentielles complications mais aussi pour envisager/réaliser une éventuelle mise au point technologique de ce DM.
Afin de minimiser les différents types de biais inhérents à l’évaluation clinique d’un DM (biais de sélection, biais de confusion, biais de mesure, biais de performance, biais de contamination…), la méthodologie statistique et le schéma d’étude doivent être soigneusement définis dans le protocole d’investigation clinique avec mention des éléments suivants :
- des objectifs clairement déterminés, de manière à évaluer avec précision l'utilisation du DM dans la population adéquate ;
- un critère de jugement approprié permettant de répondre à l’objectif de l’étude ;
- un calcul de taille d’étude formalisé avec des hypothèses cliniques pertinentes sur le critère de jugement principal et prenant en compte la faisabilité de recrutement et les potentiels patients perdus de vue ; ce calcul permet d’obtenir une réponse fiable à la question de recherche, tout en minimisant l’exposition des sujets au risque ;
- une population d’étude adaptée, reflétant la population cible du DM avec des critères d’inclusion et de non-inclusion nettement définis ;
- le choix d’un comparateur (actif, placebo), si applicable ;
- les informations sur la randomisation, si applicable, avec des techniques adéquates : randomisation centralisée, randomisation par bloc de taille fixe ou aléatoire, prise en compte des facteurs de stratification fortement corrélés au critère de jugement principal, etc. ;
- les informations sur l’insu, si applicable ; si cela est difficile ou impossible, il convient de s’assurer que l’évaluateur du critère de jugement principal est différent du responsable d’affectation du groupe ;
- le détail de la méthodologie statistique sous forme de plan d’analyse statistique très complet incluant population d’analyse, gestion des données manquantes, critères d'évaluation pour répondre à chaque objectif et méthodes adaptées à chaque critère.
Les spécificités liées au dispositif médical
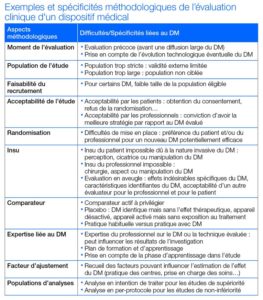
Le niveau de preuve le plus élevé pour démontrer l’intérêt d’un produit de santé reste l’étude contrôlée randomisée en double aveugle. Ce type d’étude permet de rendre les groupes étudiés comparables et donc d’imputer les résultats uniquement au dispositif étudié, tout en supprimant certains biais. Dans le cadre de l’évaluation clinique des DM, la méthodologie d’une étude contrôlée randomisée peut s'avérer difficile à appliquer, notamment en raison des spécificités présentées dans le tableau ci-dessous, qui détaille également certaines difficultés non spécifiques au DM qui peuvent être rencontrées.
Plusieurs types d’études expérimentales permettent de répondre à l’objectif défini dans le protocole d’investigation clinique du DM. Le choix du design d’étude doit prendre en considération le contexte scientifique et médical, les contraintes liées au DM, les avantages et inconvénients et également l’application du design sur la population ciblée. Parmi les différents types d’études expérimentales, on citera :
- les études randomisées conventionnelles avec ou sans insu,
- les études randomisées selon la méthode de Zelen : seuls les patients randomisés dans le groupe du DM devront signer le consentement éclairé,
- les essais fondés sur l’expertise : on randomise les patients selon l’expertise du professionnel dans l’intervention étudiée ou l’utilisation du DM,
- les essais suiveurs : des modifications au cours de l’essai sont autorisées pour prendre en compte l’évolution technologique ou l’amélioration du DM,
- les essais en cluster : on randomise des groupes d’individus (centre, hôpital…) plutôt que des individus,
- les essais en cross-over : chaque patient reçoit de manière séquentielle les interventions comparées.
De la même manière qu’il existe différents types d’études expérimentales, il existe différentes manières de les analyser, l’important étant de toujours bien définir en amont les analyses à effectuer dans le protocole d’investigation clinique. Parmi les différentes méthodologies, on citera :
- les méthodes fréquentistes qui représentent la majorité des méthodes actuellement utilisées,
- les méthodes bayésiennes fondées sur des informations existantes et prenant en considération les informations collectées pendant l’étude,
- les essais séquentiels : des analyses intermédiaires sont réalisées durant l’étude (analyse de futilité ou d’efficacité) afin, par exemple, de ne pas continuer à inclure des patients en cas d’échec ou de succès de l’étude,
- les essais adaptatifs : des analyses intermédiaires sont réalisées pour modifier le design de l’étude (ajout ou suppression de bras de randomisation, mise à jour du calcul de taille d’étude, modification des critères de jugement…)
Il existe également les essais pragmatiques qui se situent entre les essais cliniques randomisés et les études observationnelles. Les essais pragmatiques possèdent des éléments de design traditionnels des essais mais rendus plus flexibles, afin de refléter les pratiques courantes. Ce type d’essai va permettre d’évaluer l’intérêt du DM dans les conditions réelles d’utilisation et sur une population plus large.
Comme indiqué auparavant, les études expérimentales et notamment les études randomisées fournissent le niveau de preuve le plus élevé dans l’investigation clinique du DM mais les résultats de ces études peuvent être difficilement transposables aux conditions réelles d’utilisation. C’est pourquoi les études de vie réelle ou les études observationnelles apportent des compléments d’informations importants aux études expérimentales en reflétant les conditions réelles d’utilisation du DM et sont de plus en plus demandées par les autorités compétentes. Ces études offrent la possibilité de répondre à des questions que les essais cliniques n’explorent pas, notamment sur les éléments contextuels qui peuvent interagir avec l’effet propre du DM et en modifier l’efficacité en vie réelle. Parmi les différents types d’études de vie réelle ou observationnelle, on a, par exemple, les études observationnelles comparatives avec collecte de données primaires ou études de cohortes, les études basées sur des données existantes (données secondaires) comme par exemple les bases de données médico-administratives et le Système National des Données de Santé (SNDS) et les comparaisons indirectes (MAIC Matching-Adjusted Indirect Comparisons ou STC Simulated Treatment Comparison).
Des méthodologies statistiques adaptées doivent être mises en place pour ces études afin de pallier l’absence de randomisation qui permet de rendre les groupes comparables et de limiter les biais inhérents au caractère observationnel. Les méthodes permettant d’apparier les groupes, notamment en utilisant un score de propension (probabilité du patient à recevoir le DM conditionnellement à ses caractéristiques à l'entrée dans l'étude), vont tenter d’obtenir des groupes aussi comparables que possible à partir des caractéristiques initiales observées, en neutralisant ainsi les facteurs de confusion. On pourra également réaliser les analyses en ajustant sur l’ensemble des facteurs de confusion ou en réalisant des analyses de sous-groupes.
En résumé
L'investigation clinique des dispositifs médicaux est proche dans les grandes lignes de l'investigation clinique d'un médicament mais il faut prendre en compte certaines spécificités liées à la nature des DM afin de ne pas faire d'erreurs méthodologiques et de prendre le risque d'invalider une étude ou de la rendre impossible.
L'insu est une procédure dans laquelle une ou plusieurs parties d'un essai clinique ne savent pas à quels groupes de traitement les participants ont été affectés, autrement dit quel traitement ils ont reçu.
Le choix de la méthodologie la plus adaptée à l’investigation clinique d’un DM dépend du fonctionnement du DM, de l’objectif de l’étude, de la population ciblée et du contexte médical et scientifique. Un travail collaboratif entre le promoteur du DM, des experts scientifiques, des méthodologistes, des experts de la réglementation liée au DM et des experts en données de santé reste la meilleure solution pour définir au mieux la méthodologie la plus adaptée à l’investigation clinique du DM et ainsi démontrer l'utilité/l'efficacité et la sécurité du DM pour les patients.






 X (ex Twitter)
X (ex Twitter) LinkedIn
LinkedIn
























