Tests COVID-19 : un point sur la règlementation à l’approche du 26 mai
L’entrée en application, le 26 mai 2022, du règlement (UE) 2017/746 sur les DMDIV soulève la question du marquage CE des tests COVID-19. Cet article fait le point sur ces dispositifs devenus essentiels aujourd'hui, les exigences auxquelles ils vont devoir répondre et à quelles échéances.
Par Muriel Gonidec, Directrice Générale de DM Experts SAS et Laurence Matheron, membre du réseau DM Experts
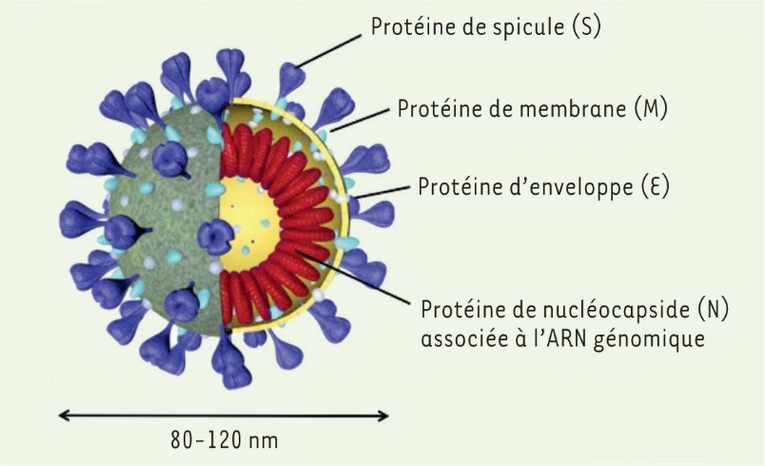
La COVID-19 a fait entrer le diagnostic in vitro (DIV) dans notre quotidien. D'après la Direction de la Recherche, des Études, de l'Évaluation et des Statistiques (DREES), le nombre de tests tracés par semaine en France en janvier dernier a frôlé les 12 millions.
Les tests antigéniques, qui détectent les protéines du virus en moins de 30 minutes, représentent la moitié des tests tracés en 20211. Leur réalisation en pratique courante permet d’alléger la charge des laboratoires. En outre, leur utilisation par des profanes (autotests, non tracés) a progressivement été autorisée et élargie jusqu’aux cas contacts ou symptomatiques.
Les techniques de test moléculaire (principalement RT-PCR), qui détectent des régions du génome du virus, se sont affinées, pour faire face à l’arrivée de nouveaux variants.
Ces variants peuvent cependant "échapper" aux tests dans deux cas de figure :
- si les mutations de l’ARN viral empêchent la reconnaissance du virus par un test RT-PCR,
- si la protéine codée par la séquence mutée est modifiée et moins bien détectée par un test antigénique.
Enfin, des avancées ont été observées au niveau préanalytique. D’autres échantillons que les prélèvements nasopharyngés sont autorisés, plus acceptables et réalisables par le patient lui-même (ou un proche) :
- le prélèvement nasal qui a ouvert la voie aux autotests,
- la salive (charge virale faible), réservée à la RT-PCR, plus sensible.
A noter que les tests autorisés début février en France se décomposent en 217 kits antigéniques, 137 kits RT-PCR simples et 10 kits RT-PCR spécifiques pour le criblage de variants.
Comment sont réglementés les tests COVID-19 ?
Actuellement, selon la directive 98/79/CE, le marquage CE des tests COVID-19, à l’exception des autotests, ne nécessite pas de recourir à un organisme notifié. Cependant, dès mars 2020, la France a mis en place des mesures nationales afin de garantir la fiabilité des tests (voir l’article en page 16 du numéro 1-2021 de DeviceMed).
A l’échelle européenne, un guide sur l’évaluation des performances des tests COVID-19 (MDCG 2021-21) est paru en août 2021 et contribue aux spécifications communes qui sont en cours d'élaboration pour certains DIV de classe D.
Avec l’entrée en application en mai 2022 du règlement (UE) 2017/746 sur les DM de diagnostic in vitro (DMDIV), les exigences réglementaires vont être très largement renforcées. Les tests COVID-19 appartenant à la classe de risque la plus élevée des DMDIV - la classe D - seront tous examinés par un organisme notifié et nécessiteront également des contrôles supplémentaires.
Dans l’immédiat, à la suite de la publication du texte entérinant l’entrée en application par paliers du règlement, les tests COVID-19 ayant une déclaration de conformité émise avant le 26 mai 2022 pourront bénéficier d’une période de grâce. Ils pourront continuer à être mis sur le marché jusqu’en mai 2025 sans devoir être examinés par un organisme notifié.
Leurs fabricants devront tout de même se soumettre à certaines conditions :
- ne procéder à aucun changement significatif dans la conception ou la destination du test pendant toute la période de grâce,
- mettre en place les exigences du règlement concernant la surveillance après commercialisation, la surveillance du marché, la vigilance et l’enregistrement des opérateurs économiques et des dispositifs dès le 26 mai 2022.
En revanche, tout nouveau test mis sur le marché après le 26 mai 2022 devra se conformer au règlement. Celui-ci impose un renforcement de l’évaluation des dispositifs de classe D.
Les dispositifs de classe D soumis à des règles plus strictes
Pour évaluer ces dispositifs, il faudra en effet faire intervenir un laboratoire de référence de l’Union européenne, pour vérifier les performances et la conformité du dispositif avec les spécifications communes ou avec les autres solutions choisies par le fabricant. En l’absence d’un avis favorable, l’organisme notifié ne pourra pas délivrer de certificat. On notera que les laboratoires de référence ne sont pas encore établis. Le guide MDCG 2022-3 vient également de préciser le contrôle des lots de dispositifs de classe D par l'organisme notifié.
Un autre impératif concernant la classe D est la consultation d'un groupe d’experts DMDIV sur le rapport d’évaluation des performances du fabricant lorsqu’il n’existe pas de spécifications communes, et qu’il s’agit de la première certification pour ce type de dispositif.
Profiter des consultations passées
Sur le site de la Commission européenne figurent déjà les points de vue du groupe d’experts DMDIV pour 5 tests COVID-19 : trois tests "sérologiques" et deux tests PCR qualitatifs pour la détection du SARS-CoV-2, seul ou simultanément avec les grippes A et B.
Il est fortement recommandé aux fabricants de tests COVID-19 de consulter ces documents. Ils apportent des informations très utiles sur les attentes du groupe d’experts aussi bien en termes de validité scientifique, que de performances analytiques ou cliniques. Les organismes notifiés se référeront très probablement à ces documents et aligneront leurs exigences à celles du groupe d’experts lorsqu’ils examineront la conformité de tests similaires ne nécessitant alors plus la consultation du groupe d’experts.
Les fabricants ont 3 ans de plus pour répondre aux exigences du RDMDIV et devront mettre à profit cette période pour collecter des données et organiser leur suivi des performances après commercialisation.
Encore un défi pour ne pas se trouver à nouveau en pénurie de tests alors que la COVID-19 devient endémique.







 X (ex Twitter)
X (ex Twitter) LinkedIn
LinkedIn
























