La FDA encourage la modélisation pour l’évaluation des DM
La modélisation et la simulation numérique sont devenues des outils essentiels pour concevoir et optimiser des dispositifs médicaux, mais ils peuvent aussi servir à obtenir plus rapidement un autorisation de mise sur le marché. C'est le cas aux États-Unis, avec une FDA qui est déjà très avancée dans ce domaine.
Donna Lochner, bureau des laboratoires Sciences et Ingénierie, FDA (Food & Drug Administration)
Rattaché à la FDA, le CDRH (Center for Radiological Devices and Health) a pour mission d’assurer la sécurité, l’efficacité, la performance et la qualité des dispositifs médicaux vendus sur le territoire américain. Cela concerne aussi n'importe quel produit émettant des radiations. Soucieux d’anticiper l’avenir, le CDRH a défini en 2016 de nouvelles priorités concernant la recherche scientifique à vocation réglementaire. Ces priorités portent notamment sur le développement de technologies de modélisation et de simulation numérique propres à faciliter la prise de décisions en matière de conformité aux réglementations en vigueur.
La FDA a récemment mis au point le programme MDDT (Medical Device Development Tools) pour lui permettre de qualifier des outils et des méthodes que les fabricants de DM peuvent utiliser pour développer leurs produits et pour les évaluer dans le cadre des demandes d’autorisation soumises au CDRH. L'idée de ce programme pilote est de fournir aux fabricants de DM et aux développeurs de ces outils MDDT, un mécanisme permettant d’étudier, en amont, la conception de nouveaux produits en partenariat avec la FDA. C'est une approche qui favorise le développement collaboratif, ainsi que l’utilisation croissante d’outils agréés.
Les dossiers de demandes d’autorisation de mise sur le marché soumis à la FDA incluent de plus en plus souvent les données de modélisation et de simulation des produits, ainsi que leur analyse technique sous forme numérique. Entre autres exemples, citons l’analyse par éléments finis (FEA) dans le cas des stents, implants orthopédiques et autres lentilles intraoculaires de chambre antérieure, ainsi que la mécanique des fluides numérique (CFD) utilisée pour les valves cardiaques ou les dispositifs d’assistance ventriculaire (VAD).
A l'ère des patients virtuels
Bien que l'utilisation de la modélisation et de la simulation numérique à des fins réglementaires accuse un certain retard dans le médical par rapport à d’autres secteurs industriels, on a commencé à constater une augmentation spectaculaire du recours à ces outils au cours de la dernière décennie. C'est le cas notamment dans les domaines suivants :
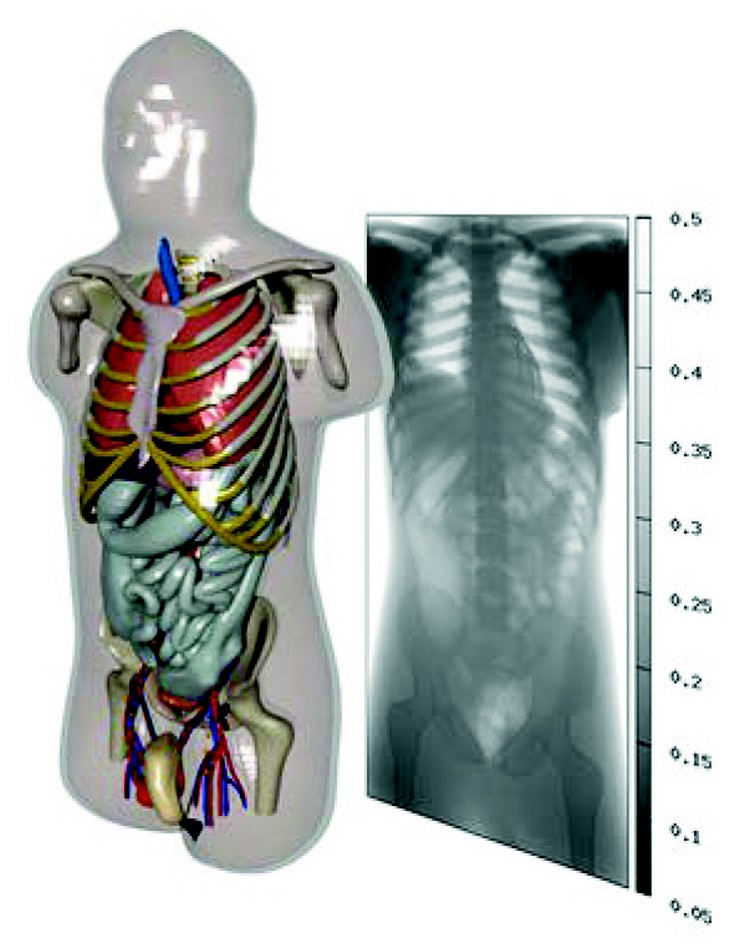
- Des modèles numériques de patients sont utilisés pour faciliter l’homologation ou l’autorisation de nouveaux dispositifs médicaux. Ces modèles de patients, tels que le jeu de modèles anatomiques virtuels Virtual Family (VF), ont déjà été exploités dans plus de 120 dossiers soumis à la FDA. Dans la plupart des cas, le recours à ces modèles VF a pour but de démontrer qu’un implant ne provoque pas de réchauffement des tissus lors d’une IRM.
- Les méthodes de modélisation de populations permettent de comprendre de façon plus approfondie les différences et les similitudes au sein d’un large éventail de jeux de données. A la clé : une amélioration potentielle de la conception des dispositifs médicaux au bénéfice d’un plus grand nombre de personnes. À titre d’exemple, le projet Musculoskeletal Atlas a pour objectif de créer un atlas statistique du système musculosquelettique, avec le concours notamment de la FDA au travers de son support des recherches extra-muros.
- Les essais cliniques virtuels s'appuient sur des approches numériques pour créer des modèles de patients et simuler une étude clinique. Ces patients virtuels peuvent être incorporés dans des études cliniques mais à certaines conditions. Il faut que les études en question aient une portée limitée ou qu'il s'agisse seulement d’enrichir une étude clinique existante en ajoutant des patients virtuels dont l'affection est faiblement représentée dans la cohorte étudiée. Les chercheurs de la FDA développent des méthodologies permettant de réaliser des essais cliniques par imagerie in silico (c'est à dire au moyen de modèles informatiques). Dans le cadre de ce projet, le programme d’imagerie 100 % numérique VICTRE (Virtual Imaging Clinical Trials for Regulatory Evaluation) sera disponible en version open source pour simuler des systèmes de mammographie en 3D. Cela représentera un avancée sensible car l’homologation de tels systèmes est, pour l’instant, obtenue au terme d’essais cliniques fastidieux.
Le CDRH est donc conscient du formidable potentiel que présentent la modélisation et la simulation informatiques en tant que méthodes efficaces d’évaluation des dispositifs médicaux. Il estime que le processus MDDT peut être utilisé pour appuyer les demandes d’agrément. Parmi les exemples de projets MDDT en cours d’évaluation auprès de la FDA figurent le logiciel de calcul édité par Vextec pour prédire les ruptures par fatigue des appareils médicaux, et le logiciel de simulation Simulia Abaqus Knee de Dassault Systèmes utilisé pour anticiper le comportement de prothèses de genoux.





 X (ex Twitter)
X (ex Twitter) LinkedIn
LinkedIn
























