Investigation clinique : le secteur de la cardiologie montre l’exemple
En cardiologie interventionnelle, la profession s'est structurée afin d'établir des critères uniformes d'évaluation de la performance et de la sécurité des DM dans le cadre des investigations cliniques. L'AFCROs nous explique comment et nous rappelle aussi quelques principes de base applicables au SCAC.
Par Cécile Bultez et Laure Morsiani du groupe AFCROs-DM
Le marquage CE est obligatoire pour les dispositifs médicaux (DM) commercialisés dans l’UE. Il indique que le dispositif a été évalué par le fabricant et qu’il a été jugé conforme aux exigences de l’UE en matière de sécurité et de performance.
Pour apposer le marquage CE sur son DM, le fabricant doit effectuer ou faire effectuer des essais qui garantissent la conformité du produit aux exigences telles que définies dans les textes réglementaires, notamment en termes de performance et de sécurité.
La révision de la réglementation sur les DM a conduit à la publication d’un nouveau règlement 2017/745 régi par les directives 93/42 et 90/385 depuis mai 2021. L’objectif principal de ce nouveau règlement a été d’harmoniser les règles applicables aux DM au sein de l’UE ainsi que de renforcer les aspects liés à la sécurité et à la transparence.
Ainsi, depuis le 26 mai 2021, tous les projets de recherches visant à évaluer la performance et la sécurité d’un DM sont encadrés par ce nouveau règlement et sont nommés investigations cliniques. En fonction de la classe du dispositif et du fait qu’il porte déjà ou non le marquage CE, ce règlement prévoit plusieurs types d’investigations cliniques.
Désormais, pour obtenir le marquage CE par exemple, il est hautement recommandé au fabricant de faire des essais comparatifs, entre son produit et celui/ceux utilisé(s) en pratique courante pour les mêmes pathologies. La robustesse méthodologique devient nécessaire pour atteindre le niveau de preuve clinique exigé.
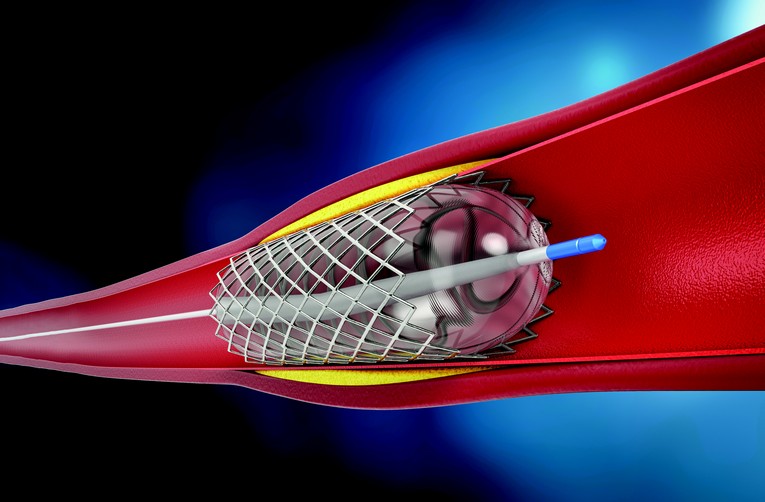
Focus sur la cardiologie interventionnelle : l'exemple du stent
Dans le domaine de la cardiologie interventionnelle, des groupes d’experts se font formés dès 2007 afin d’établir des définitions uniformes pour les critères de jugements qui seront utilisés dans l’évaluation de la performance et de la sécurité des dispositifs dans les investigations cliniques. Ces définitions sont toutes publiées sous le nom d’Academic Research Consortium (ARC).
Afin d’évaluer la sécurité d’utilisation d’un stent, les critères de référence utilisés sont les MACCE (Major Adverse Cardiac et Cerebral Events) :
- les décès de causes cardiovasculaires,
- les infarctus du myocarde,
- les revascularisations des coronaires,
- les thromboses de stent,
- les saignements,
- ainsi que les accidents vasculaires cérébraux.
La performance du stent peut être évaluée en mesurant l’évolution de la lumière interne du stent. Moins cette lumière évolue dans le temps et plus le stent sera considéré comme performant.
Pour démontrer les bénéfices cliniques, l’échelle NYHA (classification de l'insuffisance cardiaque de la New York Heart Association) doit être établie. Il est par ailleurs important de prévoir les questionnaires de qualité de vie dans le suivi des patients inclus dans l’investigation clinique.
Enfin, pour renforcer la robustesse méthodologique de sa collecte de données cliniques, le fabricant peut impliquer des experts indépendants, non investigateurs de l'étude. Ces derniers pourront :
- réaliser une revue centralisée, en aveugle, des coronarographies (core labs),
- adjudiquer les événements indésirables : le comité CEC (Clinical Events Committee) devra juger pour chaque événement indésirable grave et chaque MACCE s’il est lié à l’utilisation du stent. Cette adjudication est réalisée en aveugle afin de ne pas biaiser les résultats de cette adjudication.
Collecter des données cliniques dans le cadre du SCAC
Après la mise sur le marché de son DM, le fabricant a l’obligation de continuer à recueillir des données sur celui-ci.
Le SCAC (Suivi Clinique Après Commercialisation) est une démarche proactive de collecte et d’évaluation de données cliniques/de performance résultant de l’utilisation d’un DM marqué CE, mis sur le marché ou mis en service conformément à sa destination. C’est un processus continu de mise à jour de l'évaluation clinique qui a pour objectifs de :
- confirmer la sécurité et la performance du DM,
- identifier des effets indésirables (EI) non connus et suivre les EI et contre-indications connus,
- identifier et analyser des risques émergents,
- vérifier l’acceptabilité du rapport Bénéfice/Risque de façon continue.
Les guides MDCG 2020-7 et MDCG-2020-8 présentent toutes les données nécessaires pour conduire un SCAC.
Selon le statut réglementaire du DM (marqué CE selon l’ancienne directive 93/42 - on parle alors de « Legacy device » - ou selon le récent règlement 2017/745), l’Organisme Notifié (ON) n’aura pas la même demande en termes de données cliniques à présenter. Le fabricant pourra donc être amené à :
En France, le marché des DM en cardiologie interventionnelle est soumis à une forte concurrence.
Ce contexte implique d’associer la demande de collecte de données de suivi clinique de l’ON à une stratégie du fabricant pour le placement/développement de son DM sur le marché visé.
- mettre en place une ou des investigations cliniques,
- mettre en place une ou des études de type « registre » permettant une collecte de données cliniques massives : étude non RIPH - Recherche impliquant la personne humaine - avec Méthodologie de Référence 004 et soumission au Health Data Hub (MDR 2017/745, Annexe XIV part B)
- compléter par les données de suivi classiques : matériovigilance, bibliographie







 X (ex Twitter)
X (ex Twitter) LinkedIn
LinkedIn
























