Dossiers > Réglementation
Surveillance post-commercialisation des dispositifs médicaux
Fournisseur de logiciels pour l’industrie des sciences de la vie, Veeva Systems propose Veeva Vault Product Surveillance, une application "cloud" pour dispositifs médicaux conçue dans le but de simplifier et standardiser le processus de surveillance post-commercialisation.
Le logiciel Vault Product Surveillance a pour fonction d'automatiser les soumissions électroniques aux autorités sanitaires de manière transparente, avec un traitement proactif des réclamations pour un signalement plus rapide des événements indésirables.
« Il existe une opportunité importante pour les entreprises du dispositif médical d'alléger le lourd fardeau de la surveillance post-commercialisation avec une approche globale moderne et cohérente », déclare Carl Ning, directeur principal de Veeva Vault Quality pour ce secteur chez Veeva. « Veeva Vault Product Surveillance rationalise la surveillance post-commercialisation pour aider les entreprises à rester en phase avec les changements de réglementation et à obtenir les informations dont elles ont besoin pour promouvoir l'innovation et la qualité des produits. »
Le logiciel unifie les activités de surveillance post-commercialisation essentielles telles que le relevé des non-conformités, les actions correctives, la gestion des risques et l'audit interne à travers les processus de gestion de la qualité et des réglementations. Cela permet aux entreprises de surveiller et de traiter proactivement les réclamations, mais aussi de s'adapter aux changements règlementaires et d'obtenir généralement de meilleurs résultats de qualité.
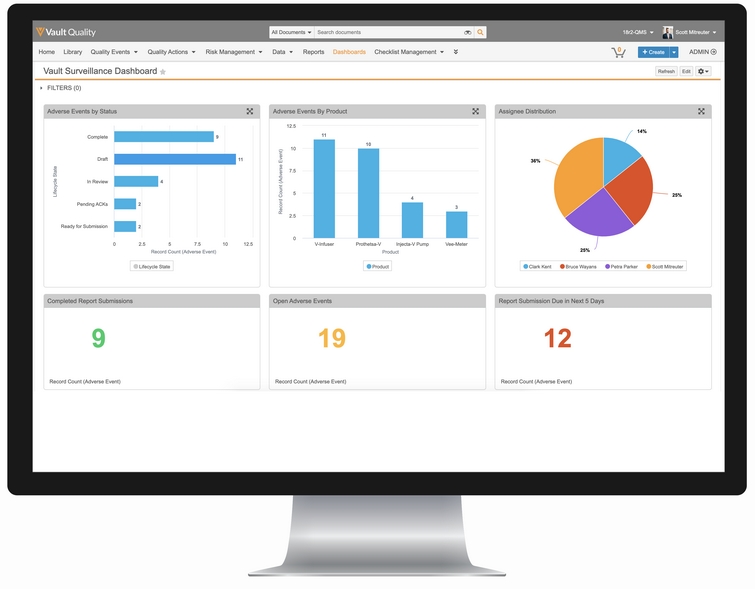
Un arbre décisionnel de signalement intelligent standardise et consolide le processus de notification des réclamations auprès des diverses autorités sanitaires afin de respecter les délais de soumission partout dans le monde. Des tableaux de bord interactifs fournissent aux équipes une visibilité en temps réel sur les retards de traitement et de signalement pour leur permettre de prendre des mesures immédiates, résoudre les problèmes, compléter les tâches et accélérer les soumissions.
Vault Product Surveillance ajoute ainsi, pour les dispositifs médicaux, de nouvelles capacités à la Veeva Vault Quality Suite qui, avec Vault QMS, Vault QualityDocs et Vault Training, permet aux entreprises de gérer la documentation et les processus de gestion de la qualité de bout en bout avec une visibilité et un contrôle accrus.
Dans un autre communiqué, Veeva a annoncé le lancement de Veeva Vault Signal, que l'éditeur qualifie de première solution du secteur à gérer les signaux de manière transparente, depuis l'identification jusqu'à l'atténuation des risques, en passant par leur évaluation.





 X (ex Twitter)
X (ex Twitter) LinkedIn
LinkedIn
























