Dossiers > Réglementation
Guide sur l’apport des données de vie réelle dans l’évaluation des DM
Des élèves de l'Université de Technologie de Compiègne (UTC) ont développé, dans le cadre d'un mémoire de Master, un nouveau guide disponible en ligne. Sa vocation est d'aider les fabricants de DM à comprendre l'utilité des données de vie réelle pour l’évaluation clinique de leurs dispositifs.
Par Aure Moisset, Loubna El Yamani, Steve Harisson Ntomegne Tchimi, Marie Josée Soh Koudjou et Jean-Matthieu Prot, du Département génie biologique, Master Ingénierie de la santé, de l'Université de Technologie de Compiègne
Le règlement (UE) 2017/745 impose de nouvelles exigences pour les fabricants de dispositifs médicaux (DM) afin de renforcer la sécurité des produits dans l’intérêt des patients et des utilisateurs. Désormais, les données destinées à l’évaluation clinique doivent commencer à être récoltées dès la conception du dispositif et leur collecte doit se poursuivre lors de l’exploitation de ce dernier dans le cadre du suivi clinique après commercialisation (SCAC).
Rappelons que l’évaluation clinique est un processus systématique et planifié visant à produire, collecter, analyser et évaluer en continu les données cliniques relatives à un dispositif afin de vérifier la sécurité et les performances, y compris les bénéfices cliniques, de celui-ci lorsqu’il est utilisé conformément à la destination prévue par le fabricant. Ces données cliniques peuvent provenir :
- De la littérature ;
- Des essais cliniques sur des dispositifs déjà existants "équivalents" ;
- Des investigations cliniques sur de nouveaux DM.
Des données qui peuvent manquer de pertinence
Chaque année, l'Université de Technologie de Compiègne organise le Rendez-vous Biomédical de l'UTC, un événement (conférences, forum métiers et table ronde) qui favorise le dialogue entre concepteurs, chercheurs, exploitants et étudiants de la medtech. C'est notamment l'occasion de découvrir des projets réalisés par les étudiants des formations biomédicales de l’UTC.
La prochaine édition aura lieu le 26 janvier 2024 sur le thème "intelligence artificielle et oncologie".
Ces données peuvent présenter certaines limites susceptibles de rendre partiels les résultats des évaluations. Cela est notamment dû au fait que la population étudiée lors des essais cliniques (population cible) ne reflète pas entièrement celle qui, à terme, va réellement bénéficier du dispositif (population rejointe). Ce souci est imputable à certains critères d’inclusion aux essais qui peuvent être restrictifs pour assurer une reproductibilité des résultats.
Par ailleurs, dans les pratiques de soins courants, le dispositif peut être "mal utilisé" ou l’observance du patient différente de celle décrite lors des essais cliniques, ce qui modifie son efficacité. De plus, les essais cliniques s’effectuent généralement sur un temps restreint, ainsi les effets à long terme et la sécurité du dispositif sont parfois insuffisamment documentés. Enfin, l’évaluation du dispositif prend malheureusement peu en compte la pertinence de ce dernier sur l’amélioration de la qualité de vie des patients. Ainsi, il arrive qu'on se heurte à un manque de données objectives dans le cadre de l’évaluation du dispositif tout au long de sa vie, en termes de sécurité, de performance, d’efficacité et d’utilisabilité. Cette insuffisance peut être comblée par l’exploitation des données de vie réelle.
Différents moyens de collecter les données de vie réelle
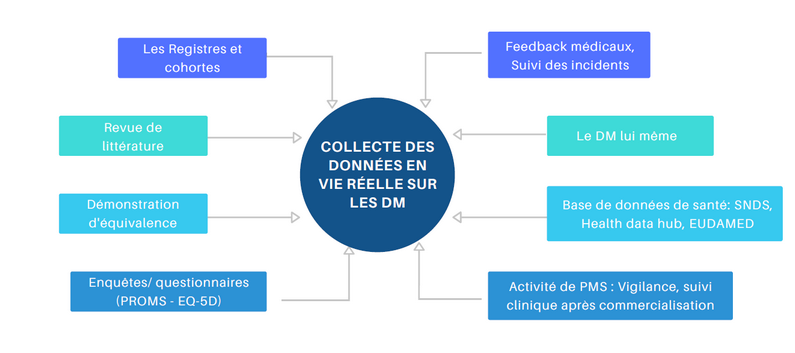
Les données de vie réelle sont constituées des données collectées en pratique de soins courants en dehors de tout cadre expérimental. Il peut s'agir de données sur une pathologie, des effets indésirables, des incidents, la qualité de vie des patients, etc. Elles peuvent être collectées grâce à des registres, cohortes, questionnaires et autres informations rapportées par le personnel médical (PROMS : Patient Reported Outcomes, EQ-5D : questionnaire standardisé sur la qualité de vie), mais aussi par une revue de la littérature ou grâce aux données issues des différentes bases de données de santé (Système National des Données de Santé, Entrepôts de données de santé hospitalier...) comme le récapitule l'illustration principale.
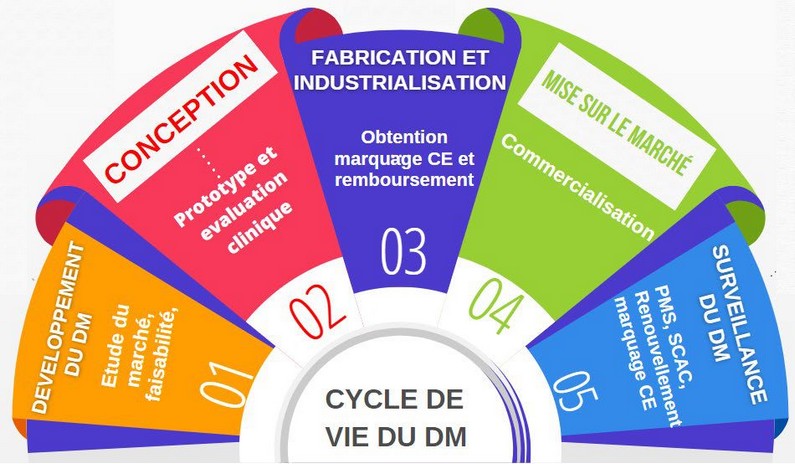
Le guide intègre une cartographie interactive regroupant les étapes du cycle de vie du DM où les données de vie réelle peuvent intervenir (crédit photo : UTC).
Le complément d’informations qu’apportent les données de vie réelle représente un enjeu significatif dans le cadre de la commercialisation du dispositif. Ces données peuvent intervenir tout au long du cycle de vie du produit pour renforcer le dossier technique, améliorer la description de l’utilisabilité, apporter des preuves nécessaires à l’évaluation clinique pendant le SCAC, enrichir le dossier de gestion des risques via les rapports d’incident et faciliter la caractérisation du rapport bénéfice-risque du DM, ou encore alimenter une demande de remboursement ou d’évolution tarifaire dans le cadre de la quantification du service rendu.
Ces données de santé sont dites "sensibles" ; leurs collecte, analyse et stockage doivent répondre au règlement général sur la protection des données (RGPD) en tenant compte a minima des impératifs suivants :
- collecter uniquement les données nécessaires ;
- garantir la transparence des données ;
- garantir le droit des personnes vis-à-vis de leurs données ;
- sécuriser les données.
Une cartographie interactive accompagnée d’une liste de guides et de référentiels
Afin d’aider le fabricant à comprendre l’apport des données de vie réelle pour l’évaluation clinique de son dispositif médical, une cartographie interactive a été élaborée regroupant les étapes du cycle de vie du produit où ces données peuvent intervenir.
Une liste de guides et de référentiels portant sur les données de vie réelle complète cette cartographie. Elle contient, pour chaque guide, un résumé, le pays concerné et l’organisme initiateur. En se basant sur cet outil, le fabricant pourra s’informer sur les référentiels disponibles, identifier les données de vie réelle utiles dans les différentes phases du cycle et donc les intégrer dans l’évaluation de son dispositif et dans la constitution de son dossier technique.
Ces outils, soumis au principe de l’amélioration continue, sont disponibles gratuitement sur le site de l’UTC à cette adresse.





 X (ex Twitter)
X (ex Twitter) LinkedIn
LinkedIn
























