Norme ISO 10993-23:2021 : quels impacts sur les essais d’irritation ?
Le monde de l’évaluation biologique des DM vit une petite révolution avec la publication, en janvier dernier, de la nouvelle norme ISO 10993-23:2021 dédiée aux essais d'irritation. Equitox détaille les changements à prévoir d'ici l'harmonisation UE de cette norme attendue pour mai 2024.

A gauche Farah Koraïchi-Emeriau, toxicologue règlementaire chez Equitox, Associée. A droite Stéphanie Moulin, toxicologue règlementaire chez Equitox, Gérante et Associée.
Par Farah Koraïchi-Emeriau et Stéphanie Moulin, Equitox
Jusqu’à présent, l'irritation et la sensibilisation étaient évaluées via une seule et même norme : la norme ISO 10993-10:2010. Désormais, l’irritation fait l’objet d’une norme à elle seule.
Grâce à cette nouvelle norme ISO 10993-23:2021, des tests in vitro d’irritation cutanée validés pour les dispositifs médicaux pourront désormais être utilisés comme alternative aux tests in vivo, à l’instar d’autres réglementations, par exemple le règlement CE des produits cosmétiques N° 1223/2009 et le règlement CE REACh N° 1907/2006 des produits chimiques. Les Annexes B et C ont été rajoutées comme support à ces tests.
Limitation des tests in vivo
L’approche "par étapes", qui existait déjà dans la norme ISO 10993-10 pour l’irritation et la sensibilisation, a été révisée et affinée pour s’adapter spécifiquement à l’irritation. En particulier, la réalisation de tests in vitro a été ajoutée comme troisième étape après la caractérisation chimique et la revue de la littérature pour compléter les informations apportées sur le potentiel irritant des constituants du dispositif médical. Ainsi, les tests in vivo ne seront envisagés que si les étapes précédentes ne permettent pas de conclure sur le potentiel irritant, ce qui renforce la prise en compte du bien-être animal et le respect des "3 R" (Remplacer, Réduire et Raffiner).
Plusieurs éléments de la norme ISO 10993-10 n’ont globalement pas été modifiés dans la nouvelle norme ISO 10993-23 :
- La caractérisation chimique demeure un prérequis aux tests d’irritation.
- Les méthodes in vivo d’irritation ainsi que les tests d’irritation chez l’Homme n’ont quasiment pas changé (sections 7 et 8).
- Les Annexes A, D (anciennement B dans l’ISO 10993-10), et E (anciennement C dans l’ISO 10993-10) demeurent pratiquement identiques. L’Annexe F, qui traitait déjà l’irritation, reste sur le même concept, avec l’ajout d’une partie détaillant les tests in vitro.
Le changement principal : l'introduction de méthodes in vitro
Les tests in vitro d’irritation cutanée de la norme ISO 10993-23 sont basés sur la ligne directrice OCDE 439 (irritation cutanée in vitro : essai sur épiderme humain reconstitué) qui a été développée pour les produits chimiques purs. Cette ligne directrice a été adaptée et validée pour détecter le potentiel irritant de composés présents dans les extraits (ISO 10993-121) de dispositifs médicaux. Le principe de ces tests in vitro repose sur le fait que l’irritation est une cascade d’événements qui, dans les phases initiales, aboutit à l’altération des kératinocytes et des cellules de la peau. La viabilité cellulaire est alors utilisée comme indicateur de l’irritation et est mesurée via la conversion enzymatique du colorant vital MTT2.
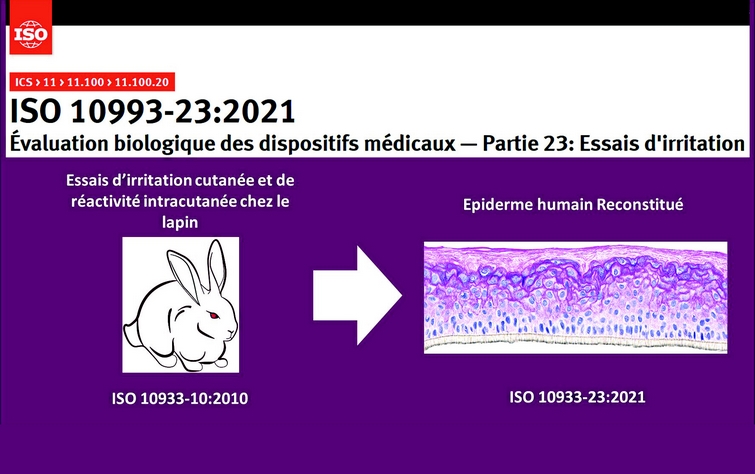
Après la caractérisation chimique et la revue de la littérature, les tests d'irritation cutanée in vitro seront désormais à privilégier par rapport aux tests in vivo en première intention (source DM Experts).
Parmi les six modèles d’Epiderme humain Reconstitué (EhR) validés dans l’OCDE 4393 , seuls les deux modèles EpiDerm™ Skin Irritation Test EPI-200 et SkinEthic™ RHE ont, pour le moment, été validés pour les extraits de dispositifs médicaux.
Ces deux modèles ont été validés par rapport aux tests de réactivité intracutanée (intradermique) et d'irritation cutanée primaire. Ce qui signifie que les tests in vitro remplaceront désormais ces deux tests in vivo. Par conséquent, il ne sera pas possible de réaliser de test in vivo en première intention (que le dispositif médical soit destiné à être en contact direct avec la peau ou bien avec les tissus), si les tests in vitro sont applicables.
Les tests in vitro sont réalisés avec des extraits polaire et apolaire. Contrairement aux tests in vivo qui permettent une gradation de l’irritation, les tests in vitro ne permettent qu’une catégorisation « binaire » de la réponse :
- si les deux extraits sont négatifs (viabilité cellulaire > 50 %), le dispositif sera considéré comme non-irritant (équivalent du grade in vivo "négligeable") ;
- si un résultat positif est obtenu avec au moins un des deux extraits (viabilité cellulaire ≤ 50 %), alors le dispositif médical sera considéré comme irritant (équivalent du grade in vivo "grave").
Dans ce dernier cas de figure, la norme stipule qu’un test in vivo peut être considéré pour catégoriser le potentiel irritant, sans pour autant indiquer qu’un tel test ne soit requis dans le cas où un résultat positif (irritant) serait obtenu dans le cadre d’un test in vitro. La norme n’est donc pas très claire sur le processus itératif et n’offre pas vraiment de guide sur ce point.
Limites et enjeux des tests in vitro
Pour les dispositifs médicaux, les tests in vitro ne sont, à la date, validés dans la norme que pour l'irritation cutanée. Pour d’autres types de contact comme l’exposition oculaire, bien que la norme recommande d’utiliser les méthodes in vitro existantes (par exemple les méthodes OCDE in vitro/ex vivo validées pour les composés chimiques purs), ces tests ne sont, pour le moment, pas encore validés.
De même, la norme ISO 10993-23 stipule que des matériaux habituellement incompatibles avec l’extraction comme les liquides, les gels et les pâtes, pourraient être testés via les tests in vitro d’irritation cutanée, mais seulement s’il est préalablement validé que ces tests sont capables de détecter correctement le potentiel irritant de ce type de matériaux.
Les tests d’irritation cutanée in vitro ne sont pas applicables pour les gaz et les aérosols. Ils ne sont également pas applicables pour les matériaux solides requérant un contact direct, car un contact étroit avec l’ensemble de la surface à tester ne peut pas être garanti dans ces tests in vitro.
Enfin, les composés extractibles susceptibles de réduire directement le MTT et/ou ceux pouvant colorer les tissus ou les cellules peuvent interférer avec le test. Ils nécessitent alors l’ajout de contrôles supplémentaires dans les tests.
Quid de l’acceptation réglementaire de l’ISO 10993-23 dans l’UE ?
La nouvelle norme ISO 10993-23 peut être considérée comme « l’état de l’art ». En tant que telle, il est donc assez probable qu’elle soit acceptée et mise en œuvre dans le cadre du MDR (Règlement (UE) 2017/745), sachant par ailleurs qu’elle a été préparée en collaboration avec le Comité Européen de Normalisation (CEN). Comme elle n'a été publiée qu’il y a quelques mois, sa mise en œuvre ne peut pas être attendue immédiatement (échéance au 27 mai 2024 sous réserve d’acceptation de la demande d’harmonisation par le CEN). Pour les dispositifs médicaux actuellement sur le marché ou qui le seront dans un avenir proche, aucun test supplémentaire d'irritation cutanée in vitro ne devrait être requis, tant que le critère d’effet d’irritation cutanée aura été correctement évalué via d’autres données comme par exemple des tests d’irritation cutanée in vivo. Toutefois, du point de vue du bien-être animal, les tests d’irritation cutanée in vitro restent le choix à privilégier en première intention.
En conclusion...
Malgré quelques limitations et challenges techniques, la nouvelle norme 10993-23 représente une avancée importante pour la toxicologie in vitro et le respect des « 3R », d’autant plus qu'elle s’oriente dans la direction requise par le nouveau règlement MDR avec une nouvelle approche de l'évaluation biologique des dispositifs médicaux.
Une révision de la norme pour la sensibilisation cutanée est également attendue mais ce challenge est encore beaucoup plus important !
1. Une version révisée de cette norme a également été publiée
en février 2021.
2. Bromure de 3-(4,5-diméthylthiazol-2-yl)-2,5-diphényltétrazolium
3. EpiSkin™ ; EpiDerm™ Skin Irritation Test EPI-200; SkinEthic™ RHE; LabCyte EPI-MODEL24 SIT; epiCS®; Skin+





 Twitter
Twitter LinkedIn
LinkedIn
























