Des outils d’aide à la surveillance post-commercialisation de DM
Des élèves de l'Université de Technologie de Compiègne (UTC) ont développé, dans le cadre d'un mémoire de Master, un guide composé de deux outils, disponibles gratuitement en ligne. Sa vocation est d'aider les fabricants de DM à mettre en place efficacement la surveillance après commercialisation.
Par Kheira Benaceur, Agathe Groell, Hajar Zkeik et Jean-Matthieu Prot, UTC
En 2018, l’ANSM a opéré 300 retraits de lots de DM après leur commercialisation à cause d'incidents affectant les patients ou les utilisateurs. Pour réduire ce risque d’incidents, le Règlement Européen 2017/745 (RDM) fait évoluer les exigences en renforçant la surveillance post-commercialisation sur l’aspect technique mais aussi clinique.
Ce processus comporte deux étapes.
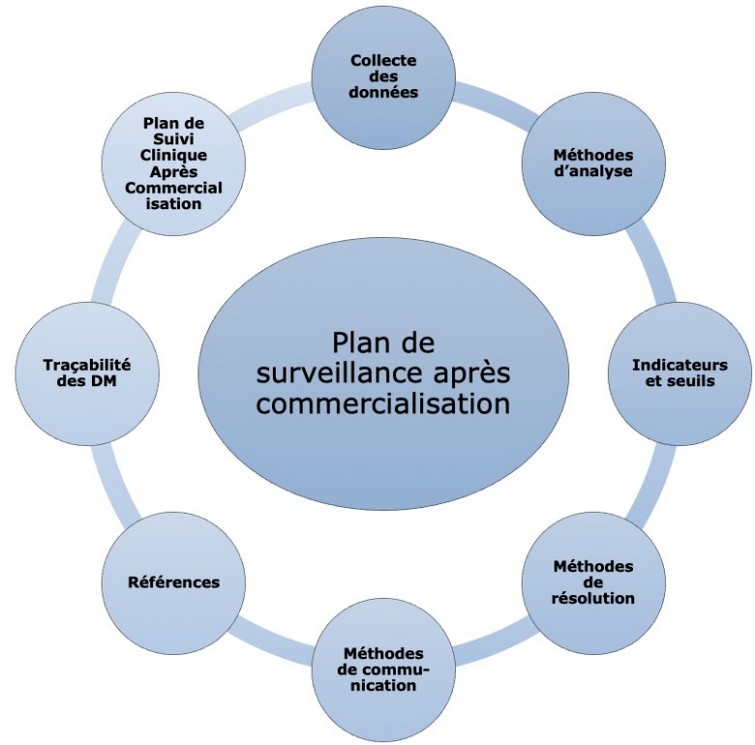
La première étape est la mise en place d’un plan de surveillance comprenant différentes phases : collecte des données techniques et cliniques, enregistrement et analyse de ces données, méthodes de résolution (mesures correctives ou préventives), traçabilité des dispositifs, etc.
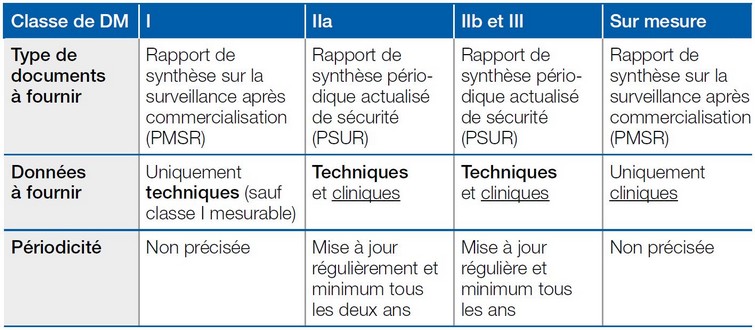
La seconde étape est l'élaboration de rapports de surveillance, périodiques ou non, contenant les données techniques et/ou cliniques suivant la classe de risque du DM (voir ci-dessous).
Plusieurs enjeux pour les fabricants
Cette évolution règlementaire se traduit par différents enjeux pour les chargés d’affaires règlementaires. Tout d’abord un enjeu de sécurité et de performance, car la surveillance post-commercialisation va permettre de déterminer les effets secondaires et indésirables inconnus du dispositif médical. Le fabricant pourra ainsi engager les mesures correctives nécessaires.
Un autre enjeu, temporel, est lié au fait que le RDM prévoit qu’une section de la documentation technique pour le marquage CE soit consacrée à la surveillance post-commercialisation. La planification de la surveillance doit donc être anticipée.
Enfin, l'enjeu économique peut être particulièrement important pour les dispositifs de classe de risque élevée, la périodicité des rapports obligeant le fabricant à rassembler et analyser des données techniques et cliniques chaque année.
Devant la multiplicité de ces enjeux et la difficulté pour un fabricant de faire face à cette évolution règlementaire, un guide a été créé dans le cadre d'un mémoire de projet en Master Ingénierie de la Santé (IDS), Parcours Dispositif Médical et Affaires Réglementaires (DMAR), à l'Université de Technologie de Compiègne.
Pour élaborer un plan de surveillance et évaluer son état d'avancement
Ce guide intègre un outil d’aide à l’élaboration du plan de surveillance post-commercialisation, et un outil de suivi d'efficacité. Basé à la fois sur le RDM et d’autres sources telles que l’ANSM, la FDA ou le guide MEDDEV 2.12/1 rev8, le premier outil se présente sous la forme d'un document PowerPoint ou PDF regroupant les étapes clés. Par un simple clic sur l’une des étapes, l’utilisateur verra s’ouvrir une fenêtre présentant l’extrait du règlement spécifié, puis une explication des différentes actions à réaliser pour mettre en place cette étape.
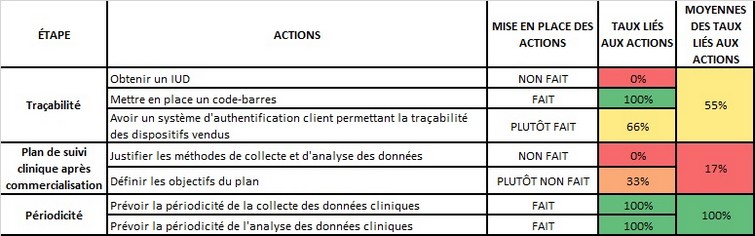
Avec un second outil, sous forme de tableau Excel, le chargé d’affaires réglementaires pourra évaluer chaque étape de son plan.
Les différentes actions peuvent être mesurées grâce à une échelle "fait - plutôt fait - plutôt non fait – non fait" , associée à des pourcentages de réalisation. Cette échelle indique à l’utilisateur une couleur lui permettant de savoir où en est la mise en place du plan de surveillance post-commercialisation.
Ces deux outils, accessibles sur le site de l’UTC à cette adresse, donnent un aperçu pragmatique de cette évolution règlementaire.





 Twitter
Twitter LinkedIn
LinkedIn
























